Hiver 2014 (volume 24, numéro 4)
Pratiques actuelles de prise en charge de la goutte par les médecins de premier recours au Canada
par Gregory Choy, M.D., FRCP;
Niloofer Baria, M.D., CCFP;
Alan Bell, M.D., CCFP;
Lydia Hatcher, M.D., CCFP, FCFP, CHE, CAPM;
Denise Sequeira, M.D.; et
Daniel Gagnon, M.D.D
Télécharger le PDF
Renseignements généraux
La goutte touche près de 3 % de la population adulte au Canada1,2. Plusieurs études ont révélé que les patients présentant des concentrations d’acide urique sérique (AUS) inférieures à 360 µmol/L obtenaient de meilleurs résultats, incluant des réductions de la fréquence des crises3,4, des réductions de la surface de tophus5,6, et l’élimination des réserves de cristaux d’urate dans le liquide synovial5,7,8. Des agents anti-inflammatoires prophylactiques devraient être prescrits au début du traitement d’abaissement chronique de l’uricémie pour éviter le risque de mobilisation6. Le contrôle inadéquat de l’hyperuricémie pourrait avoir des répercussions économiques significatives dans la société, tant sur le plan des coûts médicaux directs que par les coûts indirect9-11.
La goutte est principalement prise en charge par les médecins de premier recours12,13. L’EULAR (European League Against Rheumatism) avait développé des recommandations fondées sur les données probantes pour la prise en charge de la goutte avant le lancement de notre étude6,14-17. Toutefois, puisque les nouvelles lignes directrices de 2012 de l’American College of Rheumatology (ACR) n’ont été publiées qu’après l’achèvement de cette étude, elles n’ont pas pu être prises en considération.
Ce programme de vérification de dossiers a été conçu pour voir comment la goutte a été prise en charge par les médecins de premier recours au Canada au cours des dernières années et pour identifier toute lacune au plan des soins.
Méthodologie
Ce programme consistait en une revue observationnelle multicentrique de dossiers médicaux cliniques sur la goutte à l’échelle du Canada. De septembre 2011 à janvier 2012, le profil de 500 patients atteints de goutte et traités en consultation externe à des cliniques de premier recours a été établi. Des omnipraticiens ou médecins de famille (n = 72) ont été invités à remplir des formulaires de rapport de cas sur les dix premiers patients consécutifs se présentant à leur bureau respectif avec des symptômes de goutte documentés et répondant aux critères de sélection. Les critères d’inclusion englobaient des hommes et femmes de plus de 18 ans avec des antécédents de goutte depuis au moins un an. Les patients traités pour le cancer étaient exclus. Chaque médecin devait remplir un questionnaire de rapport de cas structuré en ligne. Le formulaire de rapport incluait les données démographiques, le fardeau de la maladie (concentrations d’AUS, nombre de crises et symptômes), les comorbidités et le traitement. Les médecins traitants ont d’abord été questionnés sur les concentrations cibles d’AUS avant d’amorcer le traitement d’abaissement de l’uricémie. Tous les patients participants ont donné leur consentement éclairé. Cette étude a été examinée et approuvée par le comité d’examen institutionnel (CEI). Les pratiques actuelles de traitement de la goutte ont été analysées par rapport aux lignes directrices de l’EULAR pour la prise en charge de la goutte. Les données ont été recueillies à l’aide d’un formulaire normalisé d’abstraction de données et ont été analysées et comparées en fonction des intervalles de confiance (IC) et du test t de Student bilatéral non apparié.
Données démographiques et caractéristiques initiales des patients
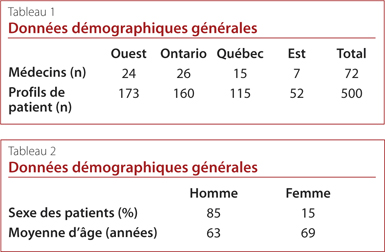
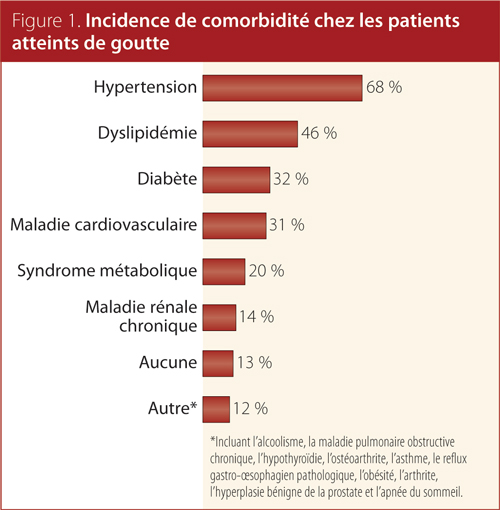
En tout, 72 médecins de famille ont été recrutés à travers le Canada et 500 profils de patient ont été établis. Les principales caractéristiques sociodémographiques et médicales de la cohorte d’étude sont résumées aux tableaux 1 et 2 ainsi qu’à la Figure 1. Environ 85 % des patients étaient des hommes et l’âge moyen était de 64 ans; le ratio homme-femme s’établissait à 6:1. La proportion de patients avec un diagnostic de goutte chronique était presque pareille partout au Canada (58 %). En moyenne, les concentrations d’AUS des patients avaient été mesurées deux fois par année depuis le début de leur traitement actuel et les patients avaient subi une crise au cours des 12 mois précédents. Environ 75 % des patients atteints de goutte chronique dans cette cohorte recevaient un traitement d’abaissement de l’uricémie. La grande majorité des patients (61 %) recevaient de l’allopurinol et 11 % recevaient du fébuxostat. Près de 60 % des patients prenaient des médicaments anti-inflammatoires sur une période moyenne de huit semaines.
Cible normalisée de concentrations d’AUS
Environ deux tiers des médecins interrogés à travers le Canada affirmaient avoir une cible thérapeutique normalisée d’AUS. Toutefois, seulement 38 % des répondants traitaient les patients atteints de goutte jusqu’à une concentration cible optimale d’AUS (concentration
d’AUS < 360 µmol/L). Près de 45 % des médecins traitaient la goutte de façon sous-optimale ou n’avaient pas connaissance d’une cible thérapeutique.
Les médecins qui traitaient jusqu’à une cible optimale avaient généralement un plus grand nombre de patients ayant présenté moins de trois crises au cours de la dernière année (43 %), comparativement à ceux ne traitant pas jusqu’à la valeur cible (56 %). La mesure moyenne de l’AUS était significativement plus basse chez les patients qui avaient présenté moins que trois crises au cours des 12 mois précédents
(378 µmol/L par rapport à 467 µmol/L, p ≤ 0,004). Dans l’ensemble, ces résultats indiquent un risque de crise de 56 % plus élevé chez les patients avec des concentrations d’AUS en dehors de la cible par rapport à ceux à la valeur cible.
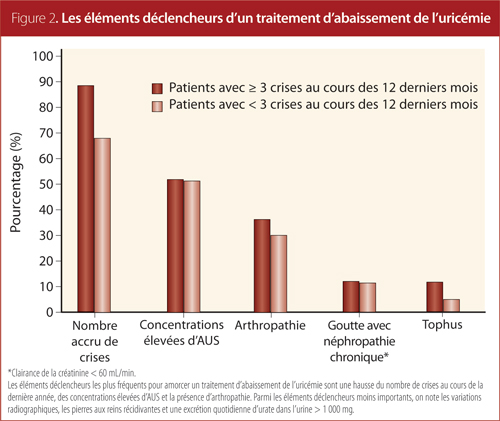
Les éléments déclencheurs d’un traitement d’abaissement de l’uricémie
Dans cette étude, plusieurs facteurs avaient incité les médecins de famille à amorcer un traitement d’abaissement de l’uricémie chez les patients atteints de goutte (Figure 2), dont notamment le nombre croissant de crises au cours de la dernière année en première position.
Durée de la prophylaxie anti-inflammatoire en association avec le traitement d’abaissement de l’uricémie
Les patients traités jusqu’à une cible optimale étaient plus susceptibles de recevoir une prescription de prophylaxie anti-inflammatoire (64 %) par rapport aux patients traités de manière sous-optimale (54 %). Les médecins prescrivaient la prophylaxie anti-inflammatoire aux patients recevant un traitement d’abaissement de l’uricémie pour une période moyenne de huit semaines, ce qui est en dessous de la durée recommandée (six mois) par le groupe de travail de l’EULAR.
Discussion
À notre connaissance, ce programme de vérification de dossiers est la première étude canadienne entreprise pour examiner les tendances dans la prise en charge de la goutte, ainsi que la qualité des soins reçus des médecins de famille par les patients atteints de goutte.
Les caractéristiques démographiques de cette population d’étude canadienne étaient semblables à celles des États-Unis et du Royaume-Uni, avec les hommes dans la soixantaine étant le groupe le plus commun. Plus de 70 % des patients recevaient un traitement d’abaissement de l’uricémie; l’allopurinol demeurait l’agent le plus fréquent et le fébuxostat représentait environ 10 % des prescriptions.
Une proportion importante des médecins de premier recours ne traitait pas jusqu’aux concentrations thérapeutiques cibles d’AUS. Les patients qui n’étaient pas traités jusqu’à la valeur cible subissaient généralement plus de crises. De plus, les patients ne recevaient souvent pas de prescription de prophylaxie anti-inflammatoire ou la durée de la prophylaxie était trop courte. Ceci était également associé à plus de crises après le début du traitement.
Cette étude comportait plusieurs limitations. Les médecins avaient été invités au hasard à participer au programme. Ceux qui ont accepté de participer pourraient avoir eu un intérêt plus marqué pour la prise en charge de la goutte, ce qui pourrait avoir eu une incidence sur nos résultats puisqu’ils ne sont pas nécessairement représentatifs de la population générale des médecins de premier recours. Un petit échantillon (n = 500) et la nature rétrospective des vérifications de dossiers ont également limité l’analyse statistique.
De façon générale, cette étude met en évidence la nécessité d’éduquer les médecins à propos de l’importance de traiter la goutte de façon plus agressive. En l’absence de mise à jour récente des lignes directrices canadiennes pour la prise en charge de la goutte, il était difficile de savoir quelles lignes directrices fondées sur les résultats probants étaient appliquées par les médecins de premier recours au Canada. L’étiologie de la goutte est bien définie et des traitements efficaces sont disponibles pour la prise en charge à court et à long terme. Une meilleure diffusion des meilleures lignes directrices pratiques est primordiale pour améliorer la qualité des soins donnés aux patients atteints de goutte.
Références :
1. Wong R, Davis AM, Badley E, et coll. Prevalence of Arthritis and Rheumatic Diseases Around the World. A Growing Burden and Implications for Health Care Needs. 2010. MOCA2010-07/002.
2. Badley E, DesMeules M. Health Canada. Arthritis in Canada. An Ongoing Challenge. Ottawa. 2003. H39-4/14-2003E.
3. Zhang W, Doherty M, Pascual E, et coll. EULAR evidence based recommendations for gout. Part I: Diagnosis. Report of a task force of the Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65(10):1301-11.
4. Perez-Ruiz F. Treating to target: a strategy to cure gout. Rheumatology (Oxford) 2009; 48 Suppl 2:ii9-ii14.
5. Becker MA, Schumacher HR Jr., Wortmann RL, et coll. Febuxostat compared with allopurinol in patients with hyperuricemia and gout. N Engl J Med 2005; 353(23):2450-61.
6. Shoji A, Yamanaka H, Kamatani N. A retrospective study of the relationship between serum urate level and recurrent attacks of gouty arthritis: evidence for reduction of recurrent gouty arthritis with antihyperuricemic therapy. Arthritis Rheum 2004; 51(3):321-5.
7. Doherty M. New insights into the epidemiology of gout. Rheumatology (Oxford) 2009; 48 Suppl 2:ii2-ii8.
8. Pascual E, Sivera F. Time required for disappearance of urate crystals from synovial fluid after successful hypouricaemic treatment relates to the duration of gout. Ann Rheum Dis 2007; 66(8):1056-8.
9. Pascual E, Sivera F. Why is gout so poorly managed? Ann Rheum Dis 2007; 66(10):1269-70.
10. Doherty M, Jansen TL, Nuki G, et coll. Gout: why is this curable disease so seldom cured? Ann Rheum Dis 2012; 71(11):1765-70.
11. Jordan KM, Cameron JS, Snaith M, et coll. British Society for Rheumatology and British Health Professionals in Rheumatology guideline for the management of gout. Rheumatology (Oxford) 2007; 46(8):1372-4.
12. Zhang W, Doherty M, Bardin T, et coll. EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2006; 65(10):1312-24.
13. Mikuls TR, Farrar JT, Bilker WB, et coll. Suboptimal physician adherence to quality indicators for the management of gout and asymptomatic hyperuricaemia: results from the UK General Practice Research Database (GPRD). Rheumatology (Oxford) 2005; 44(8):1038-42.
14. Roddy E, Zhang W, Doherty M. The changing epidemiology of gout. Nat Clin Pract Rheumatol 2007; 3(8):443-9.
15. Perez-Ruiz F, Calabozo M, Pijoan JI, et coll. Effect of urate-lowering therapy on the velocity of size reduction of tophi in chronic gout. Arthritis Rheum 2002; 47(4):356-60.
16. Li-Yu J, Clayburne G, Sieck M, et coll. Treatment of chronic gout. Can we determine when urate stores are depleted enough to prevent attacks of gout? J Rheumatol 2001; 28(3):577-80.
17. Cronstein BN, Terkeltaub R. The inflammatory process of gout and its treatment. Arthritis Res Ther 2006; 8 Suppl 1:S3.
Gregory Choy, M.D., FRCP
Chef intérimaire,
Division de rhumatologie
Centre des sciences de la santé Sunnybrook,
Toronto, Ontario
Niloofer Baria, M.D., CCFP
Directeur des Fondations de médecine,
Éducation en médecine de 1er cycle
Université de la Colombie-Britannique
Médecin de famille,
Vancouver, Colombie-Britannique
Alan Bell, M.D., CCFP
Professeur adjoint,
Département de médecine familiale et communautaire
Université de Toronto,
Toronto, Ontario
Lydia Hatcher, M.D., CCFP, FCFP, CHE, CAPM
Médecin de famille,
Family Wellness Place,
Mount Pearl, Terre-Neuve
Denise Sequeira, M.D.
Agente de liaison des sciences médicales,
Takeda Canada Inc.,
Oakville, Ontario
Daniel Gagnon, M.D.
Rhumatologue,
Centre médical et chirurgical Rockland
Montréal, Québec |



